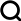-
 YL-309SПосмотреть еще YL-309S Автоматический складной дорожный/портативный электрический скутер с регулируемой высотой YL-309S — это умный электросамокат, созданный для удобного путешествия. Он оснащен автоматическим...
YL-309SПосмотреть еще YL-309S Автоматический складной дорожный/портативный электрический скутер с регулируемой высотой YL-309S — это умный электросамокат, созданный для удобного путешествия. Он оснащен автоматическим... -
 YL-985SПосмотреть еще YL-985S 4-колесный легкий портативный складной самокат с электроприводом для путешествий Особенности: Этот готовый к путешествию самокат имеет легкую, но прочную раму из а...
YL-985SПосмотреть еще YL-985S 4-колесный легкий портативный складной самокат с электроприводом для путешествий Особенности: Этот готовый к путешествию самокат имеет легкую, но прочную раму из а... -
 YL-985Посмотреть еще YL-985 4-колесный складной электрический транспортный скутер с питанием от аккумулятора Особенности: Этот легкий электрический самокат, разработанный с учетом портативнос...
YL-985Посмотреть еще YL-985 4-колесный складной электрический транспортный скутер с питанием от аккумулятора Особенности: Этот легкий электрический самокат, разработанный с учетом портативнос... -
 YL-211АПосмотреть еще YL-211 4-колесный туристический электрический скутер для пожилых людей со светодиодной фарой и корзиной Описание продукта: Этот складной электрический самокат, созданный для современной ...
YL-211АПосмотреть еще YL-211 4-колесный туристический электрический скутер для пожилых людей со светодиодной фарой и корзиной Описание продукта: Этот складной электрический самокат, созданный для современной ... -
 YL-02Посмотреть еще YL-02 Легкий 4-колесный самокат для пожилых людей с поворотным сиденьем на 360° Описание продукта: Рама: изготовленная из прочной и долговечной стали, рама обес...
YL-02Посмотреть еще YL-02 Легкий 4-колесный самокат для пожилых людей с поворотным сиденьем на 360° Описание продукта: Рама: изготовленная из прочной и долговечной стали, рама обес... -
 YL-09BПосмотреть еще YL-09B Складной 4-колесный легкий мобильный самокат с корзиной Особенности: Этот самокат комфортного класса, оснащенный прочной стальной рамой, о...
YL-09BПосмотреть еще YL-09B Складной 4-колесный легкий мобильный самокат с корзиной Особенности: Этот самокат комфортного класса, оснащенный прочной стальной рамой, о... -
 YL-07Посмотреть еще YL-07 4-колесный складной мобильный самокат с электроприводом и корзиной Особенности: Этот складной самокат сочетает в себе мобильность и повседневную прак...
YL-07Посмотреть еще YL-07 4-колесный складной мобильный самокат с электроприводом и корзиной Особенности: Этот складной самокат сочетает в себе мобильность и повседневную прак... -
 YL-09SПосмотреть еще YL-09S Складной электросамокат для взрослых и пожилых людей на дальность полета 20 км Особенности: YL-09S — прочный и универсальный самокат, созданный для повседневного...
YL-09SПосмотреть еще YL-09S Складной электросамокат для взрослых и пожилых людей на дальность полета 20 км Особенности: YL-09S — прочный и универсальный самокат, созданный для повседневного... -
 YL-07TПосмотреть еще YL-07T 4-колесный портативный складной электрический самокат для мобильности Описание продукта: Сочетая в себе удобство и практичность, этот складной элект...
YL-07TПосмотреть еще YL-07T 4-колесный портативный складной электрический самокат для мобильности Описание продукта: Сочетая в себе удобство и практичность, этот складной элект... -
 YL-08SПосмотреть еще YL-08S Сверхмощный 4-колесный складной мобильный самокат с углом подъема 12° Основные моменты: Стабильная и прочная конструкция: этот самокат имеет высокопрочн...
YL-08SПосмотреть еще YL-08S Сверхмощный 4-колесный складной мобильный самокат с углом подъема 12° Основные моменты: Стабильная и прочная конструкция: этот самокат имеет высокопрочн... -
 ЯЛ-01СПосмотреть еще YL-01S 4-колесный портативный складной моторизованный самокат для пожилых людей Особенности: Этот складной электрический самокат, созданный для современных пу...
ЯЛ-01СПосмотреть еще YL-01S 4-колесный портативный складной моторизованный самокат для пожилых людей Особенности: Этот складной электрический самокат, созданный для современных пу... -
 YL-16Посмотреть еще YL-16 4-колесный вездеходный мобильный скутер для инвалидов Особенности: Вездеходный электрический мобильный скутер, созданный для сложных усл...
YL-16Посмотреть еще YL-16 4-колесный вездеходный мобильный скутер для инвалидов Особенности: Вездеходный электрический мобильный скутер, созданный для сложных усл...
Обычай Прочный Электрический Самокат Для Передвижения Производители
Mobility Scooter — это крупная технологическая инновация в современном транспорте, предлагающая безопасный, удобный и эффективный способ передвижения для людей с ограниченной подвижностью или тех, кто ищет удобство.
Mobility Scooter, созданный с использованием передовых производственных процессов и надежных систем электропривода, стал привычным зрелищем в повседневной жизни.
Конструктивно электросамокат обычно состоит из прочной рамы, сиденья, ручки управления, шин, а также основной силовой и аккумуляторной систем. Рама изготовлена из высокопрочных и легких материалов, что обеспечивает устойчивость и портативность. Сиденье имеет эргономичный дизайн, обеспечивая комфорт даже в длительных поездках.
Эти самокаты предлагают множество функций, помимо простого передвижения. Большинство наших моделей оснащены системами освещения, обеспечивающими безопасность при поездках в ночное время или в условиях плохой видимости. Некоторые модели высокого класса также оснащены регулируемой высотой сиденья и углом наклона спинки, чтобы удовлетворить индивидуальные потребности различных пользователей.
Когда дело доходит до целевых пользователей, Mobility Scooter особенно нравится пожилым людям, поскольку он помогает им легко справляться с повседневными делами, неторопливыми прогулками и многим другим. Они также предоставляют новую независимость людям с ограниченными возможностями или тем, кто проходит реабилитацию, значительно улучшая качество жизни и делая путешествия более простыми и приятными.
-
Отраслевой опыт и важность применения Старение населения мира и растущий спрос на доступные мобильные решения в сфере здравоохранения привели к ...
Подробнее -
Предыстория отрасли и важность применения складная электрическая инвалидная коляска стала важной платформой мобильности на рынках здраво...
Подробнее -
подъемник для пациентов из алюминиевого сплава Это незаменимое устройство в современных медицинских учреждениях, предназначенное для безопа...
Подробнее -
Обслуживание и очистка скутеры для инвалидов имеет важное значение для обеспечения их оптимальная производительность, долговечность и бе...
Подробнее -
Поскольку плотность городского движения продолжает расти, компактные мобильные решения получают все более широкое распространение для поездок на ко...
Подробнее
Как гарантировать, что система силового привода электросамоката соответствует стандартам долговечности FDA и сертификации CE?
Основные требования сертификации FDA и CE к долговечности системы силового привода.
FDA (Управление по контролю за продуктами и лекарствами США) классифицирует долговечные электрические самокаты в качестве медицинских вспомогательных устройств. Стандарты долговечности ориентированы на безопасность, надежность и адаптируемость к сценариям использования пациентами. Это требует, чтобы в течение ожидаемого срока службы (обычно 5-10 лет) в энергосистеме не было функциональных сбоев, при этом особое внимание уделялось защите двигателя от перегрева, конструкции предотвращения утечек аккумуляторной батареи и стабильности системы управления. Сертификация CE (сертификация соответствия ЕС) основана на Директиве по машинному оборудованию (2006/42/EC) и Директиве по низковольтному оборудованию (2014/35/EU), уделяя особое внимание механической прочности, электробезопасности и экологичности. Например, система питания должна пройти испытание на водонепроницаемость и пыленепроницаемость IP54, испытание на температурный цикл от -20 ℃ до 50 ℃, а срок непрерывной работы двигателя при номинальной нагрузке должен составлять ≥10 000 часов.
Общие требования обоих включают в себя:
Долговечность материала: ключевые компоненты должны противостоять старению и коррозии и соответствовать директиве RoHS по защите окружающей среды;
Срок службы: степень сохранения емкости аккумуляторной батареи после ≥1000 циклов зарядки и разрядки составляет ≥80%;
Стабильность нагрузки: при номинальной нагрузке (например, 150 кг) диапазон колебаний выходной мощности составляет ≤±5%;
Отказоустойчивость: система должна иметь защиту от перегрузки, отключение короткого замыкания и функции предупреждения о неисправности.
Технический путь и стратегия реализации для обеспечения долговечности системы силового привода
(I) Оптимизация материалов и конструкции основных компонентов
Прочная конструкция двигательной системы
Что касается силового сердечника, долговечность двигателя зависит от материала обмотки, конструкции рассеивания тепла и срока службы подшипников. Например, использование постоянных магнитов NdFeB для улучшения сопротивления размагничиванию магнитной стали в сочетании с полностью закрытой структурой рассеивания тепла с водяным охлаждением позволяет контролировать рабочую температуру двигателя ниже 80°C (FDA требует, чтобы температура корпуса двигателя составляла ≤95°C). Компания Suzhou Heins Medical Equipment Co., Ltd. использует запатентованную технологию в конструкции двигателей. Его система управления двигателем оптимизирует выходной крутящий момент с помощью алгоритма векторного управления FOC и снижает влияние тока во время запуска/торможения. После испытаний он может продлить срок службы подшипников двигателя до более чем 20 000 часов, что соответствует требованиям сертификации CE по долгосрочной эксплуатации.
Управление сроком службы аккумуляторной системы
Аккумуляторный блок должен быть защищен как системой управления температурным режимом, так и системой управления батареями BMS. Аккумуляторный модуль покрыт алюминиевым корпусом авиационного класса и композитным материалом из углеродного волокна, что не только повышает прочность конструкции (устойчивость к экструзии 1000 Н без деформации), но также обеспечивает контроль разницы температур ± 2 ℃ за счет встроенного теплопроводящего силикона (FDA требует диапазон рабочих температур аккумулятора от -10 ℃ до 45 ℃). BMS необходимо контролировать напряжение, температуру и скорость зарядки и разрядки отдельных ячеек в режиме реального времени. Когда напряжение элемента батареи отклоняется от среднего значения на ≥5%, система автоматически запускает балансировочную защиту, чтобы избежать снижения срока службы, вызванного перезарядкой и чрезмерной разрядкой. Аккумуляторное решение было протестировано третьей стороной, и степень сохранения емкости достигает 85% после 1000 циклов зарядки и разрядки 1C, что превышает основные требования сертификации CE.
Конструкция надежности контроллера и системы передачи
Контроллеру необходимо использовать трехслойное лакокрасочное покрытие (влагостойкое, пыленепроницаемое и устойчивое к солевым брызгам), чтобы соответствовать уровню защиты IP65 и работать во влажной среде на открытом воздухе. Коробка передач должна пройти испытание на абразивный износ. Например, используются цементированные и закаленные шестерни из 20CrMnTi, а твердость поверхности зубьев достигает HRC58-62. После 5000 часов работы под нагрузкой износ поверхности зуба составляет ≤0,05 мм. Конструкция трансмиссии оптимизирована в патенте на складную конструкцию. За счет уменьшения зазора зацепления шестерен (≤0,02 мм) снижается рабочий шум и увеличивается срок службы трансмиссионной системы.
(II) Контроль качества производственного процесса и цепочки поставок
Гарантия точности высококачественного производственного оборудования
Точность обработки основных компонентов энергосистемы напрямую влияет на долговечность. Например, немецкий станок для лазерной резки TRUMPF, используемый компанией Suzhou Heins Medical Equipment Co., Ltd., может достигать точности резки 0,01 мм для листов моторной кремниевой стали и снижать потери в сердечнике; Японская роботизированная сварочная станция Yaskawa использует технологию отслеживания дуги, чтобы обеспечить прочность сварки ушка аккумулятора ≥50 Н, избегая увеличения контактного сопротивления, вызванного ложной сваркой (CE требует повышения температуры точки сварки ≤30 K). Современная производственная база площадью 20 000 квадратных метров, защищенная от пыли (уровень ISO8), может гарантировать, что частицы примесей во время сварки печатной платы контроллера составляют ≤0,5 мкм, что снижает риск короткого замыкания.
Полное управление отслеживаемостью цепочки поставок
Ключевые компоненты (такие как магниты двигателя и аккумуляторные элементы) должны поступать от поставщиков, прошедших сертификацию IATF16949, а каждая партия материалов должна предоставлять сертификаты материалов и отчеты об испытаниях на надежность. Например, аккумуляторный элемент должен пройти испытание на прокалывание иглой UL1642 (без возгорания и взрыва), а подшипник двигателя должен иметь сертификат срока службы таких брендов, как SKF или FAG (срок службы L10 ≥50 000 часов). Эффективная система управления цепочкой поставок может обеспечить полный контроль процесса от хранения сырья до доставки готовой продукции, гарантируя, что каждый компонент системы силового привода соответствует требованиям FDA и CE к материалам.
(III) Система многомерного тестирования и проверка соответствия сертификации
Тест на долговечность, моделирующий сценарии использования
Испытание на механическую нагрузку: закрепите прочный самокат на вибростоле, смоделируйте грубые дорожные условия с частотой 3 Гц и амплитудой ± 50 мм и дайте ему непрерывную работу в течение 500 часов, чтобы проверить усталостную прочность кронштейна двигателя и кронштейна аккумулятора (FDA требует, чтобы детали конструкции не имели трещин, а болты не были ослаблены).
Испытание на циклический цикл воздействия окружающей среды: в камере с высокой и низкой температурой и влажностью выполняйте цикл при -20℃~50℃ (каждая температурная точка поддерживается в течение 8 часов) и применяйте влажность 95% в течение 100 циклов, чтобы проверить устойчивость электронных компонентов контроллера к атмосферным воздействиям (CE требует, чтобы сопротивление изоляции после испытания составляло ≥10 МОм).
Испытание жизненного цикла: непрерывно ездить с номинальной нагрузкой (150 кг), регистрировать температуру двигателя, снижение емкости аккумулятора и частоту отказов контроллера до тех пор, пока не произойдет первый функциональный сбой, и требовать среднее время между отказами (MTBF) ≥ 10 000 часов (стандарт FDA для медицинских устройств).
Проверка соответствия сторонним сертификационным агентством
После прохождения внутреннего теста необходимо поручить одобренной FDA лаборатории (например, UL, TÜV) провести полное тестирование. Например, аккумуляторная система должна пройти тест на безопасность при транспортировке UN38.3 (обязательное требование для сертификации CE), двигатель должен пройти тест на эффективность EN 60034-1 (уровень IE3 или выше), а контроллер должен соответствовать стандарту электромагнитной совместимости EN 61000-6-3. В процессе сертификации продукция компании Suzhou Heins Medical Equipment Co., Ltd. предоставит полную техническую документацию, включая проектные чертежи, отчеты об испытаниях и сертификацию материалов, чтобы гарантировать прослеживаемость каждого звена.
(IV) Система управления качеством и механизм постоянного улучшения
Полный контроль процесса по стандартам ISO
В соответствии с требованиями ISO 13485 (Система управления качеством медицинского оборудования) и ISO 9001, производство систем силового привода должно проходить через:
Проверка проекта (DV): выявление потенциальных рисков с помощью FMEA (анализ режимов отказов) на этапе НИОКР. Например, когда уровень риска перегрева двигателя ≥8, необходимо добавить резервную конструкцию датчиков температуры;
Проверка процесса (PV): выполняется мониторинг CPK (Индекс возможностей процесса) ключевых процессов, таких как сварка и сборка, и для обеспечения стабильности процесса требуется CPK ≥ 1,33;
Проверка готовой продукции (FQC): каждая энергосистема должна пройти 100% функциональное тестирование (например, ток холостого хода, время срабатывания защиты от опрокидывания), а FDA требует, чтобы частота отказов составляла ≤ 0,1%.
Оптимизация долговечности на основе послепродажных данных
Анализируйте виды отказов с помощью гарантийных записей. Например, если емкость партии аккумуляторов слишком быстро снижается через 1 год использования, необходимо проследить формулу электролита или процесс формирования производственной партии и вовремя скорректировать параметры. Создана полноценная система обратной связи с клиентами, позволяющая отслеживать весь цикл от поставки запчастей до реализации проекта. Данные о сбоях, собранные командой послепродажного обслуживания, будут регулярно передаваться в отдел исследований и разработок для проверки долговечности продуктов следующего поколения, обеспечивая соответствие требованиям FDA к «управлению жизненным циклом» медицинских устройств.